【行业动态】力度超前,上海打响创新医械“保卫战”!
273 人阅读发布时间:2024-08-20 16:19
文章来源:医疗器械创新网
7月30日,上海发布了《关于支持生物医药产业全链条创新发展的若干意见》(下称《意见》),其中强调对创新医疗器械开发加大支持力度,鼓励企业开展原始创新,大力培育重磅产品。包括加快第二类医疗器械注册审评,加快创新产品应用推广,鼓励创新产品入院配备使用,加大创新产品医保支付支持力度,加大创新产品全球注册认证支持力度。该《意见》将于2024年8月1日实施,有效期至2029年7月31日,为期5年。
《意见》中提到,持续加大创新医疗器械开发支持力度,对进入国家和上海市创新医疗器械特别审查程序的产品,按照规定给予最高300万元支持;以上产品首次取得注册证并落地生产的,按照规定再给予不超过研发投入的40%,最高800万元支持。每个单位每年累计支持金额最高3000万元。
《意见》围绕研发、临床、审评审批、应用推广、产业化落地、投融资、数据资源、国际化等关键环节,坚持全链条创新、全链条改革、全链条赋能,推出了8方面37条政策举措。重点支持以下六个方面:
加大对创新药械研发的支持,鼓励企业开展原始创新,大力培育重磅产品。前瞻布局基因与细胞治疗、合成生物、再生医学、医疗机器人、高端医疗影像等前沿赛道。对进入国家和上海市创新医疗器械特别审查程序的产品,以及首次取得注册证并落地生产的,按照规定分别给予一定研发投入支持。
持续增设研究型床位,建设功能完备、集约共享的研究型病房。完善临床成果作价入股等转化机制,优化成果评价和团队激励机制。引导保险机构加强对临床试验和产品创新的风险补偿,完善风险共担机制。
通过建立临床预备队列等创新举措,力争将临床启动时间压缩到25周内。建立伦理审查“一套材料、一次提交”等机制,将总体流程压缩至3周内。加快第二类医疗器械审评,将审评平均时限压缩至40个工作日以内。
推动更多“新优药械”入院、入医保,确保上海市医疗机构将相应创新药械“应配尽配”。加大创新产品医保支付力度,对相关诊疗项目实行医保预算单列支付、在DRG/DIP即疾病诊断相关分组/病种分值改革中单独支付。大力支持上海市创新药械国际化发展。
强化投融资支持,发挥生物医药产业母基金、股权投资基金、创新转化基金等作用,加强战略纾困投资。鼓励政府引导基金“投早投小硬科技”。鼓励企业风险投资,设立产业并购基金,支持企业并购重组、做大做强。释放数据要素价值,推动队列研究数据开放共享,打造高质量语料库和行业数据集,推动行业数据依法合规交易、跨境安全流动。推出500万方标准化厂房,保障重大产业项目加快落地。
提升制度型开放水平,支持在上海自贸试验区(含临港新片区)符合条件的外资企业开展基因诊断与治疗技术开发和应用。优化研发用物品进口试点政策,支持细胞治疗产品及相关特殊物品进出境。充分发挥市区联动专班机制、“4个100”清单制度等作用,强化为企服务,持续打造一 、流营商环境。
生物医药是上海市重点发展的三大先 导产业之一,也是加快培育发展新质生产力的重要领域。近年来,上海市全力打造具有全球影响力的生物医药产业创新高地,推出了一系列政策举措,取得了积极的成效。
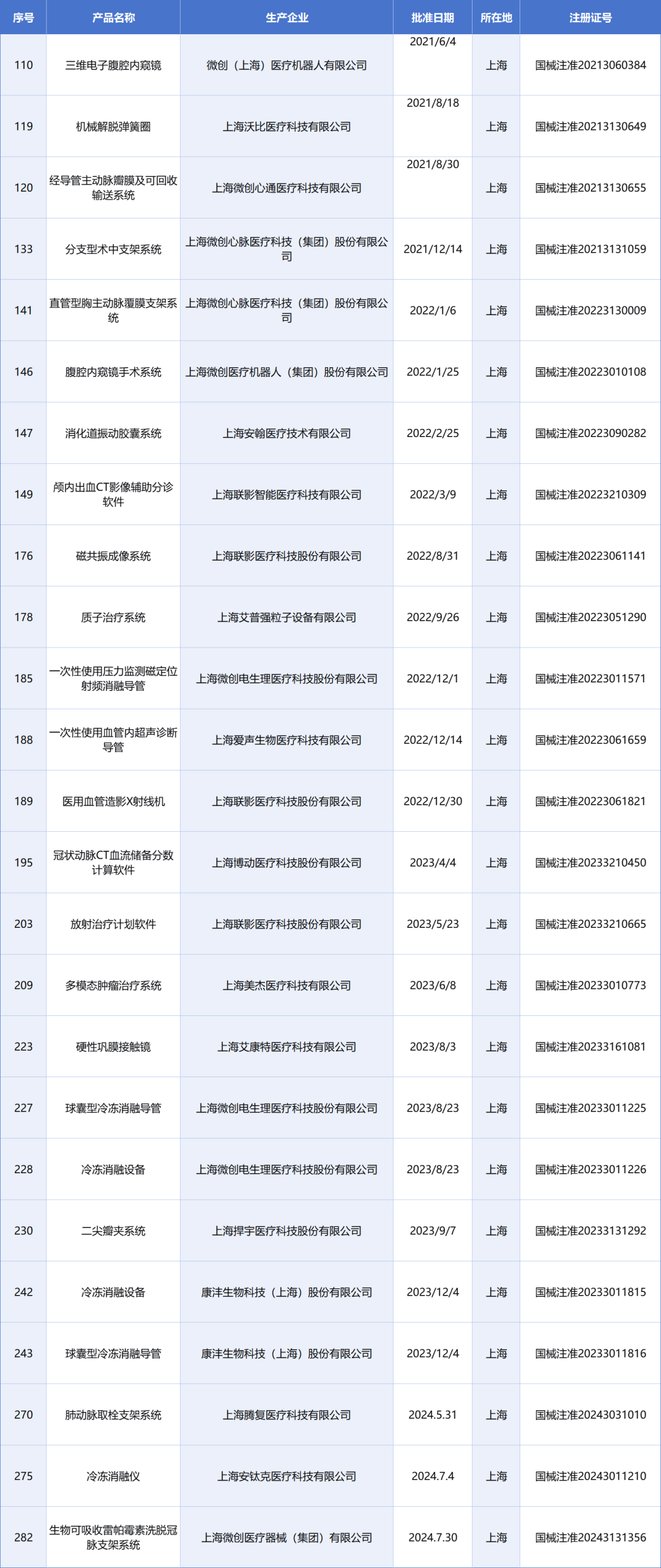
2021年,上海市发布了促进生物医药产业发展的若干意见。该意见实施以来,创新成果不断涌现,已有19款1类创新药和26款三类创新医疗器械获批上市,“首、发引领”特征进一步凸显,在肿瘤、代谢、免疫、神经等领域,涌现出了一批全球首研新药、全国首、发细胞治疗新药和国际一、流医疗器械。产业能级加快跃升,2021年至2023年,生物医药产业规模从7617亿元提升至9337亿元,制造业产值由1712亿元增长到1860亿元;今年上半年,制造业产值达到935亿元,较去年同期增加了37亿元。与此同时,细胞与基因治疗、合成生物学、医疗机器人、高端医疗影像等前沿新赛道,正在加快孕育发展新动能。
有业内专业人士表示,此次上海出台的政策力度极大,看得出上海在推进创新医疗领域的发展决心,有望让上海在现有基础上进一步取得行业领域地位。
《意见》强调了大力发展生物医药全产业链,覆盖整个研发、生产、注册、推广全生命周期,在上海已经聚集了一批头/部医疗器械及医药头部企业落户,这一政策将进一步利好本土创新医疗器械公司及跨国企业。
通过上图不难看出,以微创系为代表有10余款创新医疗器械获批上市,包括上海联影医疗、上海艾普强等10余家企业或将受益。
此外,《意见》旨在解决医械创新链条中存在的障碍和难点,目前创新产品进入医院仍然面临较大挑战,尤其是临床试验的等待时间较长。为了改善这一状况,新政策提出将第二类医疗器械的注册审评平均时间缩短至40个工作日之内。此外,对于那些具有明确临床价值且创新性突出的第二类医疗器械,政策鼓励申请特别审查程序,并给予优先处理,包括注册检验、技术审评以及注册体系核查等方面的支持。这些措施清晰地表明了政府在推动医疗器械创新发展方面的坚定决心。
除了上海,针对提升我国医疗器械创新研发,国家及各省市部门均出台了相关扶持政策。
丨 北京市医保局等九部门联合发布了《北京市支持创新医药高质量发展若干措施(2024年)》。对符合条件的创新医疗器械实施单独支付政策,即这些费用不会计入DRG(疾病诊断相关分组)支付标准之中,《中关村创新医疗器械产品目录》会定期更新。
丨国家层面,创新医疗器械在某些情况下可以豁免DRG支付模式,这意味着其费用将不计入常规的按疾病诊断分组的支付标准中。
丨2018年发布的《创新医疗器械特别审查程序》为具有中国发明专利且技术上有重大改进或填补、国内、空、白的产品提供了特别通道。此外国家医保局多次表示将充分考虑给予创新医疗器械应用的支持。
这些政策表明我国国家乃至地方政府都正积极推动医疗器械行业的创新发展,特别是在鼓励本土创新和提高国产医疗器械市场竞争力方面。相信在一些列政策扶持下,将为我国创新医疗器械领域走向快速发展阶段。